實驗求證常規凱氏定氮法的不足之處和改進方法
以經典的微量凱氏定氮法為基礎,對消化裝置進行了一定的研究和改進,使消化時間大大縮短;并針對混合指示劑必須現用現配且滴定終點不易判斷的不足,選用酸度計代替混合指示劑判斷滴定的終點,使測定結果的準確度提高。實驗表明,改良后的蛋白質含量測定方法不僅操作簡便,而且污染減少,結果更加準確。
1 試驗材料與方法
1.1 試驗儀器及試劑
1.1.1 儀器 凱氏定氮儀、微量滴定管、容量瓶 (100 mL)、錐形瓶 (100 mL、250 mL) 消化爐、漏斗 、玻璃彎管、通風櫥、酸度計、電爐。
1.1.2 試劑綠豆粉、濃度為 0.01 mol/L鹽酸標準溶液、濃硫酸、體積分數 1%硼酸吸收液、質量分數 10%硫酸銅溶液、硫酸鉀、質量分數 25%氫氧化鈉溶液、甲基紅一次甲基藍混合指示劑、30%過氧化氫、稀堿溶液、硫酸銨、草酸銨。
1.2 實驗步驟
1.2.1 消化裝置的組裝
將原微量凱氏定氮法需要固定的凱氏燒瓶換成不需要固定的 250 mL 的錐形瓶,同時在瓶口倒置一漏斗,漏斗頸頂部用玻璃彎管連接,彎管再用導管與內盛稀堿溶液的大燒杯相連。
1.2.2 消化稱取
均勻樣品 0.2~0.3 g,放入干燥的 250 mL 的錐形瓶中,再加入質量分數 10%的硫酸銅 5 mL 和0.30 g 硫酸鉀及 8.00 mL 濃硫酸,同時做空白對照實驗,搖勻后將燒瓶放在墊有鐵絲網的電爐上,在瓶口倒置一漏斗,漏斗頸頂部用玻璃彎管連接,彎管再用導管與內盛稀堿溶液的大燒杯相連。裝置安裝好后,放在通風櫥中,打開電爐,對燒瓶直接加熱,進行消化。起初用小火并隨時調節火的大小,使產生的煙氣被堿液完全吸收;待內容物全部炭化,泡沫完全停止后加強火力,隨時轉動燒瓶,使瓶壁上的內容物全部回流入消化液中,燒至溶液透明,沉淀灰白,取下待冷。將 10 mL蒸餾水沿瓶壁加入錐形瓶內,轉入 100mL 容量瓶內,以蒸餾水沖洗數次,洗液合并入容量瓶中,待冷卻后稀釋至刻度,備用。
1.2.3 測定煮沸蒸餾水 (蒸餾水發生瓶中)。
在 100 mL 錐形瓶內加入 15 mL 體積分數為 1%硼酸吸收液,置于冷凝器下,并使管口浸入硼酸內,夾緊放氣口,取10 mL 樣品稀釋液或空白液由進樣口注入反應室。以5 mL 蒸餾水沖洗樣口,用量筒量取 5 mL 質量分數25%NaOH,迅速倒入進樣口,并立即塞好,加水于進樣口,以防氨逸出,從第 1 滴溜液滴下開始計時,蒸餾 3 min,移動吸收瓶,使硼酸液面離開冷凝管口,再蒸餾 1 min,然后用少量蒸餾水沖洗冷凝管下端,從而保證了游離氨被完全蒸餾接收。氨是否完全蒸餾出來,可用 pH 試紙試驗餾出液是否為堿性而確定。取下吸收瓶,用酸度計滴定至 pH 值 5.1(取混合指示劑變色點均值),記下消耗酸的體積(mL)。繼續夾緊排氣口,提起進口塞,使蒸餾水流入反應室,捏緊進氣橡皮管,以斷絕蒸汽源。這時反應室中的廢液被自動吸出,如此反復沖洗干凈反應室,將排氣閥打開,使反應室外層中的廢液排出。
2 結果與分析
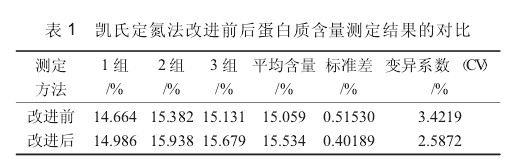
2.1 蛋白質含量測定結果對比分別采用改進前、后的凱氏定氮法,測定 3 組綠豆粉平行試樣中的蛋白質含量。凱氏定氮法改進前后蛋白質含量測定結果的對比見表 1.由表 1 可以看出,凱氏定氮法改良前后的蛋白質含量測定結果基本一致,但改進后的標準差和變異系數變小,說明改進后的測定方法具有更高的精密度。
1.2 滴定終點準確度和精密度的比較采用酸度計和指示劑 2 種方法判斷滴定終點的準確度和精密度。
不同滴定法的精密度比較見表 2,不同滴定法的準確度比較見表 3.由表 2 和表 3 可以看出,2 種方法測定結果相近,精密度和準確度都符合分析要求。由表 5 可以看出,改進后的消化時間縮短,小于原消化時間的 1/3,這可能是由于改進后的受熱面積變大,加快了消化速度;消化后產生的氣體大部分被稀堿液吸收,大大減少了有害氣體的排出。
3 結論
(1) 通過全自動定氮儀改進的凱氏定氮法,消化裝置可以縮短消化時間,從而節省了人力資源。
(2) 改進后的測定方法可明顯減少了 CO2,SO2,SO3等氣體的排放量,保護了環境,有利于人體健康。
(3) 用酸度計代替指示劑,使結果更加精密和準確。


